Einleitung
Edelgase gehören zu den faszinierendsten Elementen im Periodensystem. Sie zeichnen sich durch ihre chemische Trägheit, besondere physikalische Eigenschaften und vielfältige Anwendungen aus. Trotz ihrer scheinbaren Inaktivität spielen Edelgase in der modernen Wissenschaft, Medizin und Industrie eine zentrale Rolle. In diesem Artikel erfahren Sie alles Wichtige über die Eigenschaften, Nutzungsmöglichkeiten und die Bedeutung von Edelgasen in unserem Alltag.
Was sind Edelgase?
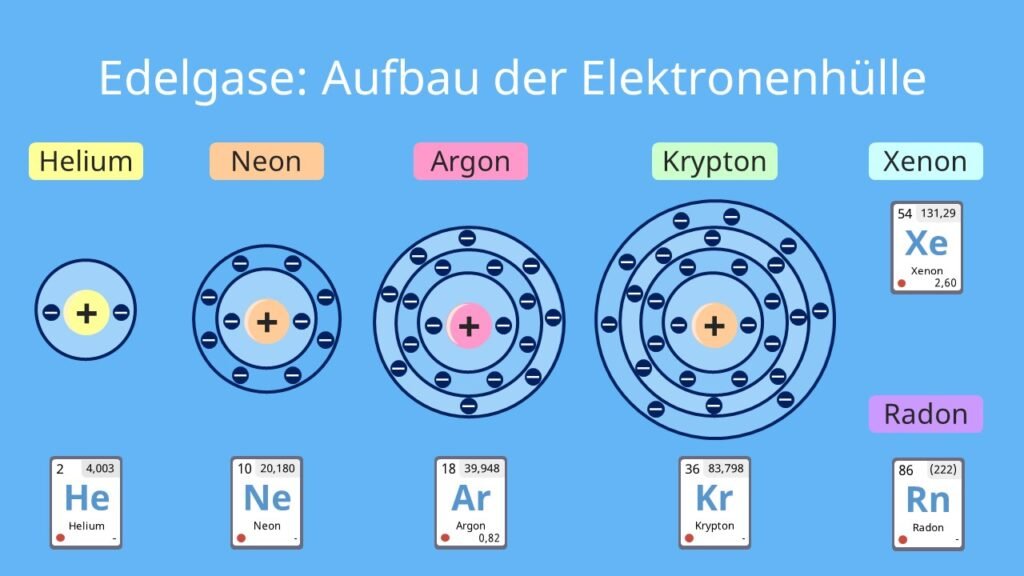
Edelgase bilden die Gruppe 18 des Periodensystems und umfassen Helium (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe) und das radioaktive Radon (Rn). Der Name „edel“ leitet sich von ihrer chemischen Stabilität ab: Edelgase besitzen eine voll besetzte Außenschale an Elektronen, was sie besonders reaktionsträge macht.
Diese Reaktionsträgheit bedeutet nicht, dass Edelgase völlig inert sind, sondern dass sie unter normalen Bedingungen kaum chemische Verbindungen eingehen. Ausnahmen zeigen sich bei extremen Bedingungen oder bei der Bildung spezieller Verbindungen wie Xenonhexafluorplatinate.
Physikalische Eigenschaften
Edelgase sind bei Standardbedingungen farb- und geruchlos sowie geschmacklos. Sie existieren alle als einatomige Gase und besitzen niedrige Schmelz- und Siedepunkte, die mit zunehmender Atommasse steigen.
- Helium: Niedrigster Siedepunkt aller Elemente, bleibt selbst bei extrem niedrigen Temperaturen flüssig.
- Neon: Leuchtet intensiv rot-orange in Gasentladungslampen.
- Argon: Am häufigsten vorkommendes Edelgas in der Erdatmosphäre.
- Krypton und Xenon: Werden aufgrund ihrer dichten Gasdichte und Leuchtfähigkeit in Speziallampen verwendet.
- Radon: Radioaktiv, selten und gesundheitlich bedenklich, tritt in bestimmten Gesteinen auf.
Die physikalischen Eigenschaften machen Edelgase besonders wertvoll für Anwendungen, bei denen Stabilität und Inertheit entscheidend sind.
Chemische Reaktivität
Obwohl Edelgase als chemisch inert gelten, können sie unter extremen Bedingungen Reaktionen eingehen. Xenon und Krypton bilden bekannte Verbindungen mit Fluor, wie Xenonhexafluorplatinate (XePtF6). Helium, Neon und Argon sind praktisch vollständig reaktionsträge unter normalen Bedingungen.
Diese begrenzte Reaktivität ist gleichzeitig ein Vorteil: Edelgase können als Schutzgas oder Füllgas eingesetzt werden, ohne chemische Reaktionen auszulösen.
Anwendungen in der Industrie
Die Vielseitigkeit von Edelgasen zeigt sich besonders in industriellen Anwendungen:
- Helium wird als Kühlmittel in supraleitenden Magneten und für kryogene Anwendungen verwendet. Zudem dient es als Traggas für Ballons und Luftschiffe.
- Neon findet sich in Leuchtreklamen, Lasern und speziellen Elektronenröhren.
- Argon wird in der Schweißtechnik, bei der Metallherstellung und als Schutzgas in der Lebensmittelindustrie eingesetzt.
- Krypton und Xenon dienen in Hochleistungslampen, Blitzen für Fotografie und als Anästhetika in der Medizin.
- Radon spielt aufgrund seiner Radioaktivität keine direkte industrielle Rolle, ist aber für geologische Untersuchungen relevant.
Diese Anwendungen zeigen, dass Edelgase trotz ihrer Trägheit eine zentrale Rolle in Technologie und Wirtschaft einnehmen.
Medizinische Bedeutung
Edelgase werden auch in der Medizin vielseitig genutzt:
- Helium wird in Mischgasen für Taucher (Trimix) eingesetzt, um Stickstoffnarkose zu verhindern.
- Xenon dient als Narkosemittel aufgrund seiner analgetischen und neuroprotektiven Eigenschaften.
- Argon wird in der Kryotherapie und in Laserbehandlungen als Schutzgas verwendet.
Die sichere, nicht reaktive Natur der Edelgase macht sie für medizinische Anwendungen besonders wertvoll, da sie keine toxischen Reaktionen hervorrufen.
Bedeutung in der Wissenschaft
In der Forschung spielen Edelgase eine zentrale Rolle:
- Spektroskopie: Neon, Argon und Krypton werden in Lichtquellen für präzise Messungen eingesetzt.
- Physik: Helium ist essentiell in Tieftemperaturphysik und Supraleitung.
- Chemische Forschung: Xenonverbindungen werden genutzt, um theoretische Modelle der chemischen Bindung zu testen.
Edelgase dienen damit nicht nur praktischen Anwendungen, sondern auch als Werkzeuge, um fundamentale wissenschaftliche Fragestellungen zu beantworten.
Umweltaspekte und Sicherheit
Edelgase sind ungiftig und nicht brennbar. Sie tragen daher nicht zur Umweltbelastung oder Luftverschmutzung bei. Radon ist jedoch aufgrund seiner Radioaktivität eine Gefahr in schlecht belüfteten Räumen, insbesondere in Kellern oder Gesteinsformationen mit hoher Radonkonzentration.
Die sichere Handhabung von Edelgasen erfordert dennoch Vorsicht: Aufgrund ihrer Dichte können schwere Gase wie Xenon und Krypton in geschlossenen Räumen Sauerstoff verdrängen. Ein ausreichender Luftaustausch ist daher notwendig.
Zukunftsperspektiven
Die Forschung an Edelgasen bleibt spannend. Heliumknappheit und steigender Bedarf in High-Tech-Anwendungen erhöhen den Druck, effiziente Recyclingverfahren zu entwickeln. Xenon wird weiterhin in der Medizin, Raumfahrt und in speziellen Laseranwendungen an Bedeutung gewinnen.
Zudem eröffnen neue chemische Studien Wege, um bisher unbekannte Edelgasverbindungen zu synthetisieren. Diese könnten künftig innovative Materialien und Anwendungen ermöglichen, die heute noch undenkbar erscheinen.
Fazit
Edelgase sind weit mehr als „träge“ Gase. Ihre einzigartigen physikalischen und chemischen Eigenschaften machen sie unverzichtbar in Wissenschaft, Medizin und Industrie. Sie stehen beispielhaft dafür, wie scheinbar einfache Elemente große Bedeutung erlangen können. Von der Kryotechnik über Lichttechnologien bis hin zur modernen Medizin – Edelgase verbinden Stabilität mit Vielseitigkeit und bleiben ein faszinierender Bestandteil unseres technologischen Fortschritts.